Cathie Wood 提4種生物醫療革命 基因編輯將消滅奇難雜症 醫癌症不用靠器官捐贈 身體會自然生長「新器官」?
撰文:經一編輯部|圖片:unsplash
在ARK的Big Idea報告內提到:
「下一代DNA測序(NGS)是基因組革命背後的驅動力。」
長讀測序
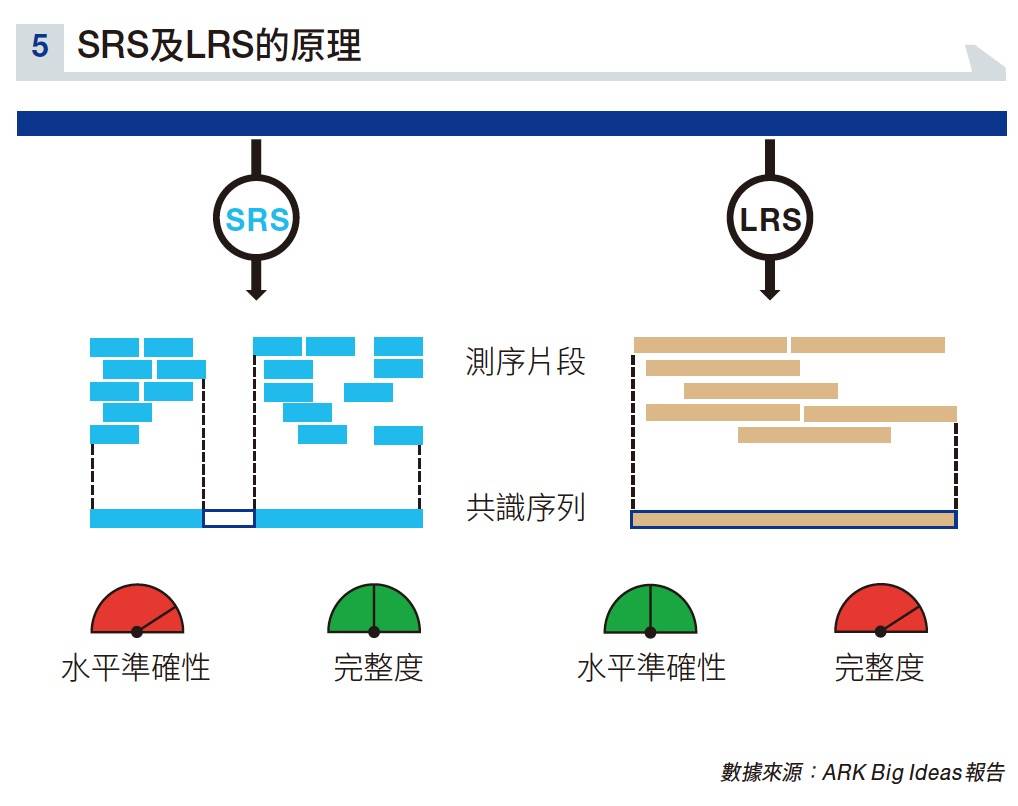
下一代的測序正是長讀測序(Long-Read Sequencing, LRS),在過去短讀測序(Short-Read Sequencing , SRS)佔了主導地位,但ARK認為長讀測序將迅速獲得市場分額,原因是新技術可提供人類基因組的更完整圖片。
究竟LRS和SRS系統的分別是甚麼?
事實上,兩種的技術均涉及三個程序:將基因組分成較小的片段;用高分辨率光學元件分析片段;用高效的計算機算法重新組裝基因組。SRS把很多測序片段(reads)小片段(150 bp),混合成共識序列(consensus sequence)。
該方法捕獲小的突變,但無法檢測到較大的改組(稱為結構變體),亦不能看到隱藏在重複基因組區域(例如AAAA)中的突變。
較舊的LRS系統讀取的讀數較大(> 10,000-bp),雖然在每個鹼基的水平準確性較差,但卻提供了更完整的基因組圖譜。
雖然LRS系統有自身的缺點,但技術受惠於深度學習的算法,例如Google的DeepVariant有助提升合成式、納米孔的LRS技術的效用。
在成本方面,雖然納米孔LRS準確度不高,但基因組排序的成本只需500美元,成本效益較SRS高,有望做到全民排序。合成式LRS技術雖然比較昂貴,但準確度比SRS高2.5倍,比納米孔LRS高30倍。
根據ARK的估計,使用LRS進行人類基因組測序的成本將降至100至200美元,與SRS一致,到2025年底,其準確性將優於所有SRS(見圖表五)。
LRS適合一些臨床應用,例如兒科重症監護環境下,其快速全基因組測序(WGS)的報銷率很高,診斷提供者利用LRS可有更大的靈活性。
在ARK看來,無論序列內容如何,LRS工具都可以提供最全面的變異檢測。
ARK認為,由於較低的測序成本以及對高精度和完整結果的需求,對LRS的需求已達到拐點。包括測序耗材,儀器和服務在內,到2025年LRS的收入,可能會從2.5億美元增長到50億美元。
多癌篩查
所有實體瘤均遵循從局部可治療到轉移性和致死性的可預測路徑,為早期發現提供了依據。
在五年內,惡性轉移癌症僅佔新病例的17%,但導致所有癌症死亡的55%。局部癌的平均五年生存率為89%;而惡性轉移癌僅為24%。
除了體細胞突變、循環蛋白和免疫標記外,機器學習算法已將DNA甲基化浮出水面,作為用於早期癌症檢測的新型且高度敏感的生物標記。
下一代DNA測序(NGS)的成本快速下降,使液體活檢成為可能性。合成生物學的進步,幫助臨床醫生在高噪聲環境中,可發現癌症的微弱訊號。
目前的多癌症篩查費用不便宜,隨著人口規模的臨床效用數據激增,ARK認為1,500美元的價格,將會打開65至80歲的多癌症篩查市場,而這正是癌症發病率達到頂峰的年齡段。
當價格降至1,000美元以下時,幾乎可以對40歲以上的所有年齡段的人,進行成本有效的篩查,僅在美國,就可能挽救多達140萬人的生命。
雖然1,500美元的單價可以打開市場,但1,000美元的單價甚至可以改變癌症死亡率曲線。
創新技術之間的融合,使多癌症篩查的成本從2015年的30,000美元下降到如今的1,500美元,降低20倍;而據ARK的研究,到2025年,成本再下降了80%至250美元。
如果被完全採用,僅在美國,多癌篩查就應擴大到1,500億美元的市場。
細胞和基因療法:第二代
第二代細胞和基因療法,會從以下三個方向改變:液體腫瘤到實體腫瘤;細胞療法由異體,變為自體;基因編輯將由離體,變為體內。
液體腫瘤到實體腫瘤:一般來說,癌症療法通常是會先測試到液體腫瘤(即血液惡性疾病,如淋巴瘤、多發性骨髓瘤、血癌),但實體腫瘤卻佔診斷出的癌症的88%。
美國食品和藥物管理局(FDA)在10年的試驗,其中七年是集中在實體腫瘤,其後批准了口服化療藥物Gleevec。
從這個時間表來看,FDA可能會在2025年批准首個針對實體腫瘤的CAR-T治療。
AI、基因編輯和NGS的幫助下,失敗率應該降低和上市時間加快,從而加快批准率。
細胞療法由異體,變為自體:「同種異體細胞療法」涉及「現成」或捐贈的細胞;而「自體細胞療法」則可修飾患者自身的細胞。
「同種異體療法」的一種風險是宿主免疫系統,或會攻擊新改造細胞,儘管存在這種風險,同種異體細胞仍可改善癌症早期階段的治療,並將成本降低一個數量級。
而在ARK看來,向同種異體試驗的轉變將會繼續。
離體到體內基因編輯
目前的離體基因編輯,指的是在體外修飾患者的細胞,然後將其移植回患者體內;而體內基因療法則可在身體內修飾患者體內的細胞。與體外不同,體內療法無法在轉導(Transduction)前,檢查已編輯的細胞。
也就是說,體內基因療法更具成本效益,並且更易於製造和量產。
它還使人們能夠更多地接觸肝臟、眼睛、中樞神經系統(CNS)和肌肉。體內基因治療,可使基因編輯隨時間的推移,治療數千種罕見疾病。
ARK認為,根據典型的試驗失敗率進行調整,在未來十年中,約有170種基因療法,可能會被批准並商業化。
包括TIL、TCR和CAR-T細胞療法,細胞免疫療法的創新,可以使市場總量(TAM)增長近三倍,在當前130億美元的TAM中增加300億美元。
異基因療法使在癌症的早期階段更容易應用,或使TAM增加700億美元。細胞療法創新和同種異體細胞的結合,可增加1,500億美元的收入,並使腫瘤基因療法的總體TAM約增20倍,達到2,600億美元以上。
免責聲明:本專頁刊載的所有投資分析技巧,只可作參考用途。市場瞬息萬變,讀者在作出投資決定前理應審慎,並主動掌握市場最新狀況。若不幸招致任何損失,概與本刊及相關作者無關。而本集團旗下網站或社交平台的網誌內容及觀點,僅屬筆者個人意見,與新傳媒立場無關。本集團旗下網站對因上述人士張貼之資訊內容所帶來之損失或損害概不負責。