【新冠肺炎】FDA公布緊急使用授權指引 新冠疫苗美國大選前面世無望
廣告
美國食品及藥物管理局(FDA)周二公布新冠肺炎疫苗的「緊急使用授權」(emergency use authorization)的新指引,表明希望得到最後階段臨床測試志願者打第二針兩個月後的追蹤數據,來協助評估疫苗。染疫的美國總統特朗普早前力推新冠疫苗加快研製,連番聲稱「很快有疫苗供應」,冀疫苗可趕及在11月3日大選前面世,如今FDA發出新指引,意味新冠疫苗不可能在投票日前上市。
FDA強調,第三階段的測試數據,應包括已完成的疫苗注射後的追蹤期中位數至少為兩個月的數據,以協助提供充分資訊來評估疫苗的效用及風險。
FDA局長:疫苗研發過程盡可能公開透明
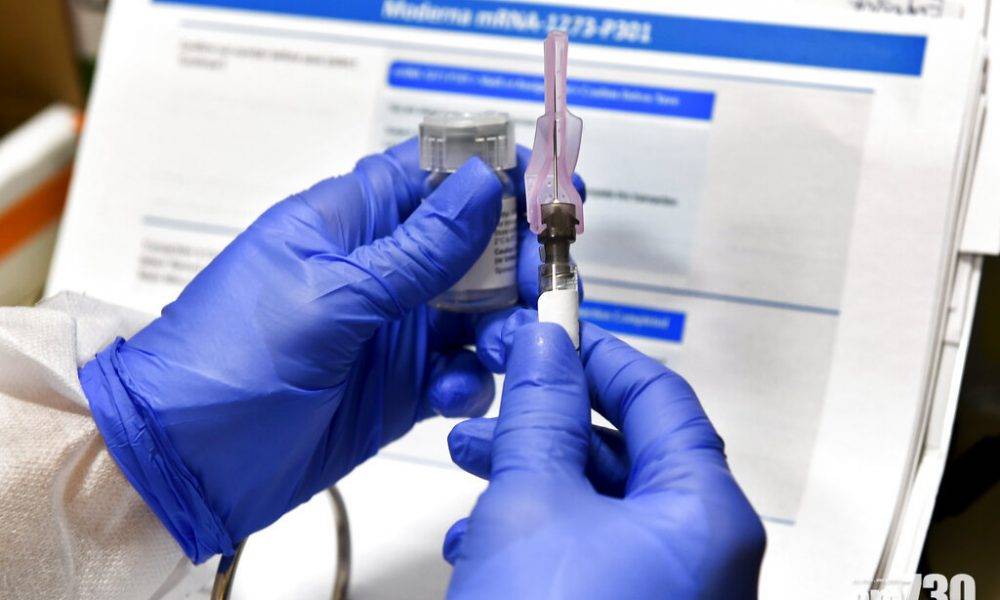
美國莫德納(Moderna)及輝瑞(Pfizer)研發的新冠肺炎疫苗,已在7月底展開最後階段臨床測試,均要求兩劑疫苗注射必須相隔28天。FDA早前已規定,疫苗須證明其有效度比安慰劑多50%;在注射安慰劑的對照組中,必須有至少5名重症患者。這意味僅有參與試驗的頭一批少數人能在10月底前完成規定的追蹤期,因此可能無法向FDA提供充分數據來申請緊急使用授權。FDA局長哈恩(Stephen Hahn)周三在Twitter發文指:「FDA致力於使新冠疫苗研發過程及科學評估,盡可能公開與透明。」
FDA局長:疫苗研發過程盡可能公開透明
美國莫德納(Moderna)及輝瑞(Pfizer)研發的新冠肺炎疫苗,已在7月底展開最後階段臨床測試,均要求兩劑疫苗注射必須相隔28天。FDA早前已規定,疫苗須證明其有效度比安慰劑多50%;在注射安慰劑的對照組中,必須有至少5名重症患者。這意味僅有參與試驗的頭一批少數人能在10月底前完成規定的追蹤期,因此可能無法向FDA提供充分數據來申請緊急使用授權。FDA局長哈恩(Stephen Hahn)周三在Twitter發文指:「FDA致力於使新冠疫苗研發過程及科學評估,盡可能公開與透明。」
FDA公布疫苗緊急使用授權最新指引,美媒報道,白宮認為兩個月的追蹤期沒必要,不希望FDA實施相關規定,有報道指白宮與FDA為此陷入拉鋸。許多醫療及衛生專家讚揚FDA,指FDA在政治壓力下仍勇敢處事。
資料來源:AM730